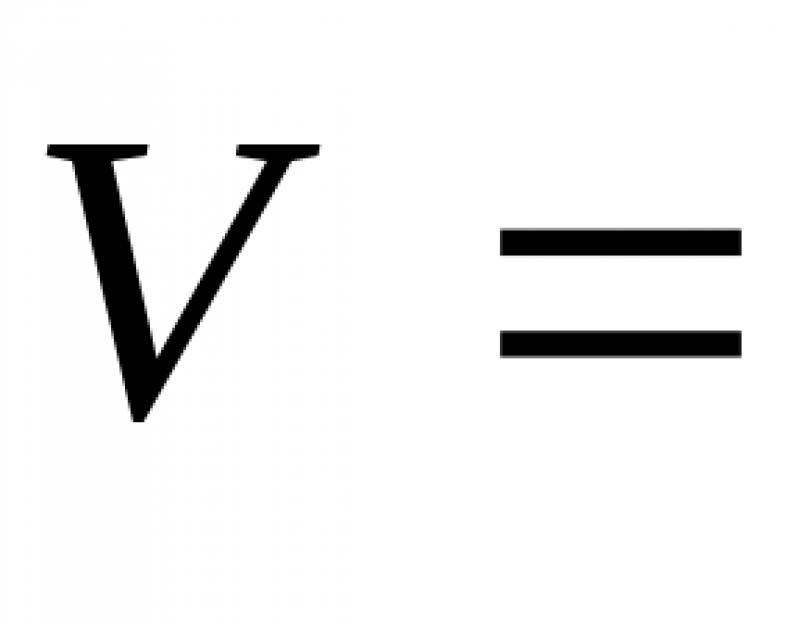Берем тиосульфат натрия и три кислоты (серную, соляную и ортофосфорную):
Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S + H2O
Na2S2O3 + 2 HCl = 2 NaCl + SO2 + S + H2O
3 Na2S2O3 +2 H3РO4 = 2 Na3РO4 + 3 SO2 + 3 S + 3 H2O
Наливаем в три пробирки по 8 мл раствора тиосульфата натрия. В первую пробирку с раствором тиосульфата натрия наливаем 8 мл серной кислоты, быстро перемешиваем и засекаем время в секундах от начала реакции до помутнения раствора. Чтобы лучшее заметить окончание реакции, с противоположной стороны стенки пробирки приклеиваем полоску черной бумаги. Отчет времени заканчиваем в момент, когда эта полоска не будет просматриваться сквозь помутневший раствор.
Аналогично проводим опыты с другими кислотами. Результаты заносим в таблицу (приложение 1, таблица 1). Скорость реакции определяем как величину, обратно пропорциональную времени: υ = 1/ t. На основании таблицы строим график зависимости скорости реакции от природы реагирующих веществ (приложение 2, график 1).
Вывод: таким образом, природа кислот оказывает влияние на скорость химической реакции. А, так как сила кислот определяется концентрацией ионов водорода, то скорость реакции зависит и от концентрации реагирующих веществ.
Б. Рассмотрим реакцию взаимодействия различных металллов с соляной кислотой. Скорость реакции будем определять по объему выделившегося водорода, который собираем методом вытеснения воды (приложение 3, рисунок 1).
В четыре пробирки поместим по 0, 05 г. металлов: магния, цинка, железа и меди. Поочередно в каждую пробирку (а) наливаем одинаковые объемы соляной кислоты (1:2). Водород, который будет быстро веделяться, поступит в пробирку (б). Отмечаем время, за которое пробирка заполняется водородом. На основании результатов (приложение 4, таблица 2) строим график зависимости от природы реагирующих веществ (приложение 4, график 2).
Вывод: не все металлы могут взаимодействовать с кислотами путем выведения водорода. Металлы, вытесняющие водород из растворов кислот, расположены в ряду Н.Н. Бекетова до водорода, а металлы, которые водород не вытесняют – после водорода (в нашем случае это медь). Но и первая группа металлов различаются по степени активности: магний-цинк-железо, поэтому и интенсивность выделения водорода различна.
Таким образом, скорость химической реакции зависит от природы реагирующих веществ.
2. Зависимость скорости химической реакции от концентрации взаимодействующих веществ.
Цель. Установить графическую зависимость влияния концентрации на скорость реакции.
Для проведения опыта используем те же растворы тиосульфата натрия и серной кислоты, которыми пользовались в первом опыте (А).
В пронумерованные пробирки наливаем указанные количества миллилитров раствора тиосульфата натрия и воды. Вливаем в первую пробирку 8 мл раствора серной кислоты, быстро перемешиваем и замечаем время от начала реакции до помутнения раствора (смотри опыт 1 А). Проводим аналогичные опыты с остальными пробирками. Результаты заносим в таблицу (приложение 6, таблица 3), на основании которых строим график зависимости скорости химической реакции от концентрации реагирующих веществ (приложение 7, график 3). Аналогичный результат мы получили, оставляя постоянной концентрацию тиосульфата натрия, но меняя концентрацию серной кислоты.
Вывод: таким образом, скорость химической реакции зависимт от концентрации реакнгирующих веществ: чем выше концентрация, тем скорость реакции больше.
3. Зависимость скорости химической реакции от температуры.
Цель: проверить, зависит ли скорость химической реакции от температуры.
Опыт проводим с растворами тиосульфата натрия и серной кислоты (смотри опыт 1), дополнительно готовим химический стакан, термометр.
В четыре пробирки наливаем 8 мл раствора тиосульфата натрия, в 4 другие – 8 мл раствора серной кислоты. Все пробирки помещаем в стакан с водой и измеряем температуру воды. Через 5 минут вынимаем две пробирки с растворами тиосульфата натрия и серной кислоты, сливаем их, перемешиваем и замечаем время до помутнения раствора. Стакан с водой и пробирками нагреваем на 10оС и повторяем опыт со следующими двумя пробирками. Проводим такие же опыты с остальными пробирками, повышая каждый раз температуру воды на 10оС. Полученные результаты записываем в таблицу (приложение 8, таблица 4) и строим график зависимости скорости реакции от температуры (приложение 9, график 4).
Вывод: данный эксперимент позволил сделать вывод, что скорость химической реакции увеличивается с повышением температуры на каждые 10оС в 2–4 раза, т.е. доказал справедливость закона Вант-Гоффа.
4. Влияние катализатора на скорость химической реакции.
Цель: проверить, зависит ли скорость химической реакции от катализатора, и обладают ли катализаторы специфичностью.
А. Для проверки специфичности катализатора мы использовали реакцию разложения перекиси водорода: 2Н2О2 = 2Н2О + Н2. Брали 3% раствор, разложение перекиси водорода идет очень слабо, даже опущенная в пробирку тлеющая лучинка не разгорается. В качестве катализаторов мы брали диоксид кремния SiO2, диоксид марганца MnO2, перманганат калия KМnO4, хлорид натрия NaCl. Только при добавлении порошка оксида марганца (IV) произошло бурное выделение кислорода, тлеющая лучинка, опущенная в пробирку, ярко разгорелась.
Таким образом, катализаторы – это вещества, которые ускоряют химическую реакцию, и, чаще всего, для конкретной реакции необходим «свой» катализатор.
5. Кинетика каталитического разложения перекиси водорода.
Цель: выяснить зависимость скорости реакции от концентрации веществ, температуры и катализатора.
Разложение очень слабого раствора пероксида водорода начинается под влиянием катализатора. С течением реакции концентрация перекиси водорода уменьшается, о чем можно судить по количеству выделяющегося кислорода в единицу времени. Опыт проводим в приборе (приложение 10, рисунок 2): в пробирку помещаем 0,1 г порошка двуокиси марганца, присоединяем ее к резиновой трубке, в колбу наливаем 40 мл 3-процентного раствора перекиси водорода, соединяем с помощью резиновой трубки с пробиркой. Заполняем цилиндр (бюретку) водой, опускаем в кристаллизатор, закрепляем в зажиме штатива вертикально, подводим под него газоотводную трубку от колбы Вюрца. Без катализатора выделение кислорода не наблюдаем. После добавления двуокиси марганца каждую минуту в течение 10 минут отмечаем и записываем в таблицу объем выделившегося кислорода (приложение 11, таблица 5). На основании данных строим график зависимости объемов выделившегося кислорода от времени (приложение 12, график 5)
6. Влияние поверхности соприкосновения реагирующих веществ на скорость химической реакции.
Цель. Выяснить, влияет ли поверхность соприкосновения реагирующих веществ на скорость гетерогенной химической реакции.
На весах взвесили одинаковое количество (0,5 г) мела (СаСО3) в виде кусочка и порошка, поместили навески в две пробирки, в которые налили одинаковое количество соляной кислоты (1:2). Наблюдаем выделение углекислого газа, при чем в первой пробирке (мел в виде кусочка) реакция идет менее энергично, чем во второй (мел в виде порошка) (приложение 13, фотографии 1,2): СаСО3 + 2 HCl = CaCl2 + CO2 + H2O
Преподаватель: Кораблёва А.А.
ОТЧЕТ
О ЛАБОРАТОРНОЙ РАБОТЕ
ПО КУРСУ: ОБЩАЯ ХИМИЯ
" СКОРОСТЬ РЕАКЦИИ В РАСТВОРАХ "
ОФ 62 5528 1.04 ЛР
Работу выполнил
студент группы
Санкт – Петербург
Цель работы:
Определить константу скорости, температурный коэффициент, энергию активации реакции взаимодействия тиосульфата натрия с серной кислотой.
В данной лабораторной работе изучается реакция между тиосульфатом натрия (гипосульфитом) Na2S2O3 и серной кислотой H2SO4.
Эта реакция протекает в две стадии:
1) (быстро)
Первая стадия ионного обмена протекает практически мгновенно. Тиосерная кислота неустойчивое соединение, распадающееся с выделением белого осадка серы.
2) (медленно)
О скорости реакции можно судить по появлению опалесценции и дальнейшему помутнению раствора от выпавшей серы.
Суммарная реакция определяется второй стадией процесса и зависит от концентрации H2SO4 , а значит и Na2S2O3 (реакция псевдомолекулярна).
 Кинетическое
уравнение имеет вид:
Кинетическое
уравнение имеет вид:
Приборы и реактивы:
Термостаты, термометры, мерные цилиндры, пробирки, пробиркодержатели, секундомер, растворы Na2S2O3 и H2SO4 .
Опыт №1:
Влияние тиосульфата на скорость химической реакции.
Зависимость скорости реакции от концентрации тиосульфата натрия.
Обработка результатов опыта:
Рассчитываем относительную скорость реакции по формуле:
2. Исходя из кинетического уравнения, определяем значение константы скорости реакции:
Р
3. Определяем среднее значение константы для данной комнатной температуры, в данном случае Т = 14 град цельс.
4 .
Выразить зависимость скорости реакции
от концентрации тиосульфата – графически.
(см. рис.№1).
.
Выразить зависимость скорости реакции
от концентрации тиосульфата – графически.
(см. рис.№1).
5. Графически определяем константу скорости реакции как тангенс угла наклона прямой ОА к оси абсцисс. Сравниваем графически определенную константу с ее аналитическим значением.
КГР = tg = 0.162 КСР = 0.17 КГР КСР
Опыт №2:
Влияние температуры на скорость химической реакции.
|
Температура опыта, Т, град цельс. |
реакции t, с |
Относит. скорость реак. V, 1/с |
Конст. скор. реак. К, л/моль*с |
|
Обработка результатов опыта:
1.Рассчитываем относительную скорость реакции при каждой температуре:
Результаты смотреть в вышеприведенной таблице.
2.Исходя из кинетического уравнения определяем значение константы для каждой температуры:
Р езультаты
смотреть в вышеприведенной таблице.
езультаты
смотреть в вышеприведенной таблице.
3.Выражаем графически влияние температуры на скорость химической реакции. (см. рис.№2).
4.Исходя из уравнения Ван-Гоффа определяем для каждого температурного интервала значение температурного коэффициента и вычисляем его среднее значение:
К2/К1 = 1 = 2.42
К3/К2 = 2 = 1.97 сред = 2.3
К4/К3 = 3 = 2.49
5 .
Исходя из уравнения Аррениуса вычисляем
аналитическое значение энергии активации
для каждого температурного интервала:
.
Исходя из уравнения Аррениуса вычисляем
аналитическое значение энергии активации
для каждого температурного интервала:
Е а1
= 61785 Дж/моль Еа2
= 50729 Дж/моль Еа3
=72882 Дж/моль
а1
= 61785 Дж/моль Еа2
= 50729 Дж/моль Еа3
=72882 Дж/моль
И вычисляем его среднее значение:
ЕаСРЕД = 61798 Дж/моль
6. Выстраиваем графическую зависимость lgK от 1/Т по вычисленным константам скоростей при разных температурах и определяем энергию активации графическим способом (см. рис. №3).
tg = - Еа / 2.3 R , следовательно
ЕаГР = -2.3 R tg = -2.3 * 8.3 * tg = 19.09* 3230 = 61660 Дж/моль
7. Сравниваем значения энергии активации полученные графическим и аналитическим путем:
ЕаГР = 61660 Дж/моль ЕаСРЕД = 61798 Дж/моль ЕаГР ЕаГР
Вывод:
При температуре равной const, скорость химической реакции пропорциональна концентрации веществ, участвующих в этой реакции. (см. рис.№1)
С увеличением температуры скорость химической реакции увеличивается
При условии, что концентрация остается неизменной. Это можно объяснить тем, что с ростом температуры атомы веществ переходят в более возбужденное состояние, т. е. они получают дополнительную энергию – энергию активации, необходимую для разрыва химической связи и образования нового вещества.
Тиосерная кислота. Тиосульфат натрия. Получение, свойства, применение.
К эфирам серной кислоты относятся диалкилсульфаты (RO2)SO2. Это высококипящие жидкости; низшие растворимы в воде; в присутствии щелочей образуют спирт и соли серной кислоты. Низшие диалкилсульфаты - алкилирующие агенты.
Диэтилсульфат (C2H5)2SO4. Температура плавления -26°С, температура кипения 210°С, растворим в спиртах, нерастворим в воде. Получен взаимодействием серной кислоты с этанолом. Является этилирующим агентом в органическом синтезе. Проникает через кожу.
Диметилсульфат (CH3)2SO4. Температура плавления -26,8°С, температура кипения 188,5°С. Растворим в спиртах, плохо - в воде. Реагирует с аммиаком в отсутствие растворителя (со взрывом); сульфирует некоторые ароматические соединения, например эфиры фенолов. Получают взаимодействием 60%-ного олеума с метанолом при 150°С, Является метилирующим агентом в органическом синтезе. Канцероген, поражает глаза, кожу, органы дыхания.
Тиосульфат натрияNa2S2O3
Соль тиосерной кислоты, в которой два атома серы имеют различные степени окисления: +6 и -2. Кристаллическое вещество, хорошо растворимо в воде. Выпускается в виде кристаллогидрата Na2S2O3 5Н2O, в обиходе называемый гипосульфитом. Получают взаимодействием сульфита натрия с серой при кипячении:
Na2SO3+S=Na2S2O3
Как и тиосерная кислота, является сильным восстановителем, Легко окисляется хлором до серной кислоты:
Na2S2O3+4Сl2+5Н2О=2H2SO4+2NaCl+6НСl
На этой реакции было основано применение тиосульфата натрия для поглощения хлора (в первых противогазах).
Несколько иначе происходит окисление тиосульфата натрия слабыми окислителями. При этом образуются соли тетратионовой кислоты, например:
2Na2S2O3+I2=Na2S4O6+2NaI
Тиосульфат натрия является побочным продуктом в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от серы. Применяется для удаления следов хлора после отбеливания тканей, Для извлечения серебра из руд; является фиксажем в фотографии, реактивом в иодометрии, противоядием при отравлении соединениями мышьяка, ртути, противовоспалительным средством.
Тиосерная кислота - неорганическое соединение, двухосновная сильная кислота с формулой H 2 SO 3 S. Бесцветная вязкая жидкость, реагирует с водой. Образует соли - неорганические тиосульфаты. Тиосерная кислота содержит два атома серы, один из которых имеет степень окисления +4, а второй - электронейтрален.
Получение
· Реакция сероводорода и триоксида серы в этиловом эфире при низких температурах:
· Действие газообразного хлористого водорода на тиосульфат натрия:
Физические свойства
Тиосерная кислота образует бесцветную вязкую жидкость, не замерзающую даже при очень низкой температуре. Термически неустойчива - разлагается уже при комнатной температуре.
Быстро, но не мгновенно, разлагается в водных растворах. В присутствии серной кислоты разлагается мгновенно.
Химические свойства
· Термически очень неустойчива:
· В присутствии серной кислоты разлагается:
· Реагирует со щелочами:
· Реагирует с галогенами:
Образует сложные эфиры - органические тиосульфаты.
Тиосульфа́т на́трия (антихлор , гипосульфит , сульфидотриоксосульфат натрия ) - Na 2 S 2 O 3 или Na 2 SO 3 S, соль натрия и тиосерной кислоты, образуеткристаллогидрат Na 2 S 2 O 3 ·5H 2 O.
Получение
· окислением полисульфидов Na;
· кипячение избытка серы с Na 2 SO 3:
· взаимодействием H 2 S и SO 2 с NaOH (побочный продукт в производстве NaHSO 3 , сернистых красителей, при очистке промышленных газов от S):
· кипячение избытка серы с гидроксидом натрия:
затем по приведённой выше реакции сульфид натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO 2 .
· чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
· растворение сульфида натрия в воде в присутствии кислорода воздуха:
Физические и химические свойства
Бесцветные моноклинные кристаллы. Молярная масса 248,17 г/моль (пентагидрат).
Растворим в воде (41,2 % при 20 о С, 69,86 % при 80 о С).
При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100 о С.
При нагревании до 220 °C распадается по схеме:
Тиосульфат натрия - сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Более слабыми или медленно действующими окислителями, например, иодом, переводится в соли тетратионовой кислоты:
Приведённая реакция очень важна, так как служит основой иодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия иодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается:
Расплавленный кристаллогидрат Na 2 S 2 O 3 ·5H 2 O очень склонен к переохлаждению.
Применение
· для удаления следов хлора после отбеливания тканей
· для извлечения серебра из руд;
· фиксаж в фотографии;
· реактив в иодометрии
· противоядие при отравлении: As, Br, Hg и другими тяжёлыми металлами, цианидами (переводит их в роданиды) и др.
· для дезинфекции кишечника;
· для лечения чесотки (совместно с соляной кислотой);
· противовоспалительное и противоожоговое средство;
· может использоваться как среда для определения молекулярных весов по понижению точки замерзания (криоскопическая константа 4,26°)
· в пищевой промышленности зарегистрирован в качестве пищевой добавки E539 .
· добавки для бетона.
· для очищения тканей от иода
· Марлевые повязки, пропитанные раствором тиосульфатом натрия, использовали для защиты органов дыхания от отравляющего вещества хлора в Первую мировую войну.
2.1. Цель работы: определить влияние различных факторов на скорость химической реакции, ознакомиться с методами определения средней константы скорости, порядка реакции, энергии активации.
2.2. Объекты и средства исследования: 0.1М растворы тиосульфата натрия и серной кислоты, дистиллированная вода, пробирки, две бюретки, пипетка на 2мл, термостат, секундомер.
2.3. Программа работы
2.3.1. Влияние концентрации на скорость реакции .
В результате реакции между серной кислотой и тиосульфатом натрия образуется сера, выделяющаяся в виде мути. Время от начала реакции до момента помутнения (голубоватой опалесценции) зависит от скорости реакции. Это дает возможность судить о средней скорости реакции.
Реакция идет в три стадии:
1) Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + Н 2 S 2 O 3
2) Н 2 S 2 O 3 = H 2 SO 3 + S¯
3) H 2 SO 3 = H 2 O + SO 2
Суммарное уравнение:
Na 2 S 2 O 3 + H 2 SO 4 = Na 2 SO 4 + SO 2 + S¯ + H 2 O
Самая медленная, скоростьопределяющая, стадия – вторая, следовательно, скорость всего процесса зависит только от концентрации тиосерной кислоты. Так как тиосерная кислота получается в результате реакции ионного обмена, которая идет практически мгновенно, можно считать, что концентрация тиосерной кислоты равна концентрации тиосульфата натрия и скорость всего процесса зависит от концентрации тиосульфата натрия.
Ход работы .
Приготовить четыре раствора тиосульфата натрия разной концентрации согласно таблице 3. Поочередно к каждому раствору прибавить по 2мл 0,1М раствора серной кислоты и измерить время от момента приливания кислоты до момента появления помутнения. Результаты занести в таблицу 3, учитывая что ΔС есть величина постоянная, равная 4×10 -3 моль/л.
Таблица 3
На основании полученных данных построить график lgV = f (lgC) для определения порядка реакции при температуре T 1 (К). Графики строятся вручную на миллиметровой бумаге в соответствующем масштабе или в программе Microsoft Excel 2007.
Для построения графиков в программе Microsoft Excel 2007 необходимо занести исходные данные в электронную таблицу.
Затем необходимо выделить диапазон ячеек A2:B5 с данными и выбрать в меню Вставка – Диаграммы – Точечная и, выделив на графике полученные точки, выбрать в контекстном меню Добавить линию тренда – Линейная – Показывать уравнение на диаграмме x ) и есть n – порядок реакции. Например, n = 0,9919 ≈ 1
Для определения константы скорости реакции k 1 при комнатной температуре следует построить график зависимости V = f(C) также вручную или с помощью программы Microsoft Excel 2007.
Для построения графиков в программе Microsoft Excel 2007 занести исходные данные в электронную таблицу. Обратите внимание, что для столбца скорость (V ) необходимо выбрать формат ячеек экспоненциальный . В результате получаем график прямолинейной зависимости, в уравнении которой множитель при независимой переменной (x ) является константой скорости реакции.
Например, k = 1,6· 10 -3
2.3.2. Влияние температуры на скорость реакции.
Опыт проводить аналогично предыдущему. Однако растворы тиосульфата натрия и серной кислоты перед смешением предварительно нагреть в термостате в течение 5 минут.
Результаты записать в таблицу 3 (T 2).
По результатам расчетов и измерений построить график V = f(C) и определить константу скорости реакции k 2 при повышенной температуре (Т 2), также используя возможности программы Microsoft Excel 2007. Найти температурный коэффициент скорости реакции:
На основании данных опытов 3.1.1. и 3.1.2. рассчитать энергию активации реакции Е акт. по формуле:
где R = 8,31 Дж/(моль·К) –универсальная газовая постоянная;
Т 1 и Т 2 -температура, К;
k 1 и k 2 - константы скорости реакции при температурах Т 1 и Т 2 , соответственно, с -1 .
Конец работы -
Эта тема принадлежит разделу:
Неорганическая химия
Министерство образования и науки РФ.. Федеральное государственное бюджетное.. Учреждение высшего профессионального образования..
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
| Твитнуть |
Все темы данного раздела:
Химическая посуда
1.1. Цель работы: Изучить виды и назначение химической посуды.
1.2. Теоретические сведения
Используемую в лабораториях химическую посуду можно разделить на несколь
Мерная химическая посуда и приемы работы с ней
Мерную посуду используют для измерения объемов жидкостей. К ней относятся: мерные колбы, цилиндры, пипетки и бюретки (рис.3).
На правила работы с мерной посудой надо обратить
Весы и правила взвешивания
1.1. Цель работы: Познакомиться с приборами для взвешивания. Научиться взвешивать на лабораторных технических весах.
1.2. Теоретические сведения.
Для определения м
Запрещается превышать максимальную грузоподъемность весов
Перед взвешиванием проверяют готовность весов к работе:
1. устанавливают их по уровню,
2. выверяют нулевое положение стрелки.
Взвешиваемый предмет помещают на левую чашку
Очистка природной воды
3.1. Цель работы: познакомиться с методами очистки природной воды.
3.2. Объекты и средства исследования: два химических стакана на 300-500 мл, коническая воронка, колба Вюр
Очистка дихромата калия перекристаллизацией
4.1. Цель работы: освоить методику очистки веществ перекристаллизацией.
4.2. Объекты и средства исследования: коническая воронка, химические стаканы на 100 мл, мерный цилин
Очистка йода возгонкой
5.1. Цель работы: освоить методику очистки твердых веществ возгонкой.
5.2. Объекты и средства исследования: химический стакан без носика на 200-300 мл, круглодонная колба н
Определение плотности жидкостей, температуры плавления и температуры кипения веществ
6.1. Цель работы: ознакомиться с физическими характеристиками веществ и методами их определения.
6.2. Объекты и средства исследования: жидкие индивидуальные вещества (гексан, гептан, октан
Получение оксида свинца и металлического свинца из его соли
9.1. Цель работы: ознакомление с методами осаждения, фильтрования, высушивания и прокаливания осадков, а также с восстановлением металлов и их оксидов.
9.2. Объекты и средс
Определение молярной массы легко испаряющихся веществ
1.1. Цель работы: освоить методы определения молярных масс легко испаряющихся веществ и расчеты по уравнению Менделеева-Клапейрона.
1.2. Объекты и средства исследования: со
Определение молярной массы углекислого газа
2.1. Цель работы: освоить методы определения молярных масс газообразных веществ, используя уравнение Менделеева-Клапейрона и относительные плотности газов.
2.2. Объекты и средства ис
Определение молярной массы эквивалентов металлов
3.1. Цель работы: ознакомиться с методом определения молярной массы эквивалентов металлов в реакции взаимодействия металлов с разбавленными кислотами.
Свойства гидроксидов
1.1. Цель работы: изучить реакции получения и свойства гидроксидов
1.2. Объекты и средства исследования: 0,5М растворы сульфата меди(II), сульфата алюминия, хлорида хрома(I
Получение и изучение свойств аммино- , гидроксо- , ацидо- и аквакомплексов
1.1. Цель работы: познакомиться с методами получения, химическими свойствами и устойчивостью комплексных соединений.
1.2. Объекты и средства исследования: 0,5М растворы иод
Измерение тепловых эффектов химических реакций
1.1. Цель работы: выполнение калориметрических измерений и термодинамических расчетов, связанных с энергетикой химических реакций.
1.2. Объекты и средства исследования: кал
Влияние изменения концентрации реагирующих веществ на химическое равновесие
3.1. Цель работы: установить, как влияет изменение концентрации реагирующих веществ на химическое равновесие.
3.2. Объекты и средства исследования: 0,1М раствор хлорида железа (III), насыщ
Способы выражения концентрации растворов
Способ выражения концентрации
Формула
Название и определение
Обозначения и единица измерения
Явления, наблюдаемые при растворении
1.1. Цель работы: изучить явления, происходящие при растворении твердых, жидких и газообразных веществ в воде, объяснить наблюдаемые явления с точки зрения гидратной теории растворо
Определение растворимости веществ в воде
2.1. Цель работы: изучить свойства насыщенных и пересыщенных растворов, научиться определять растворимость веществ, изучить зависимость растворимости различных веществ от температур
Образование и растворение осадков
3.1. Цель работы: изучить условия образования и растворения осадков.
3.2. Объекты и средства исследования: 1н растворы нитрата свинца (II), хлорида натрия, хлорида магния, хлорида бария, б
Приготовление и титрование растворов
4.1. Цель работы: ознакомиться с методами приготовления растворов и определения их концентрации, выраженной в различных единицах. Освоить метод титрования растворов. Определить врем
Определение жесткости водопроводной воды
5.1. Цель работы: изучить метод объемного анализа растворов (титрование) при определении временной жесткости водопроводной воды. Научиться производить расчеты по концентрации электр
Определение электропроводности раствора и константы диссоциации слабого электролита
6.1. Цель и задачи работы: изучить кондуктометрический метод анализа. Установить зависимость удельной и эквивалентной электропроводности от концентрации раствора. Изучить закон разбавления Оствальд
Гидролиз солей
7.1. Цель и задачи работы: изучение процессов гидролиза солей различного типа. Установление влияния температуры, разбавления, реакции среды, заряда иона-комплексообразователя на сте
Задача 866.
Написать уравнение реакции получения тиосульфата натрия. Какова степень окисленности серы в этом соединении? Окислительные или восстановительные свойства проявляет тиосульфат-ион? Привести примеры реакций.
Решение:
Уравнения реакций получения тиосульфата натрия:
а) Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия
:
Na 2 SO 3 + S + 5H 2 O ↔ Na 2 S 2 O 3 . 5H 2 O.
Водный раствор сульфита натрия кипятят в присутствии серы, а затем охлаждают, выделяется кристаллогидрат тиосульфата натрия.
б) Окисление полисульфидов кислородом воздуха:
2Na 2 S 5 + 3O 2 ↔ 2Na 2 S 2 O 3 +6S.
в) Получение тиосульфата натрия путём взаимодействия серы со щёлочью. Реакция протекает с одновременным окислением и восстановлением серы:
4S + 6NaOH ↔ Na 2 S 2 O 3 + 2Na 2 S +3H 2 O.
г) Непосредственное взаимодействие сернистого ангидрида с сероводородом в щелочной среде. Для этого смесь обеих газов пропускают при сильном размешивании в раствор едкого натра до его нейтрализации, то образуется тиосульфат натрия:
4SO 2 + 2H 2 S + 6NaOH ↔ 3Na 2 S 2 O 3 + 5H 2
Атомы серы, входящие в состав тиосульфатов имеют различную степень окисленности; у одного атома степень окисленности равна +4, у другого 0.Тиосульфат-ион S 2 O 3 2- проявляет свойства восстановителя. Хлор, бром и другие сильные окислители окисляют его до сульфат-иона SO 4 2- , например:
Взаимодействие тиосульфата натрия
с хлором (при его избытке):
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ 2H 2 SO 4 + 2NaCl + 6HCl
Ионно-молекулярное уравнение:
S2O 3 2- + 4Cl 2 0 + 5H 2 O ↔ 2SO 4 2- + 8Cl - + 10H +
Молекулярная форма:
Na 2 S 2 O 3 + 4Cl 2 + 5H 2 O ↔ 2H 2 SO 4 + 2NaCl + 6HCl l
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4, другого – от +4 до +6.
Под действием слабого окислителя тиосульфат натрия окисляется до соли тетратионовой кислоты
H 2 S 4 O 6 .
Взаимодействие тиосульфата натрия с йодом:
2 Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
2S 2 O 3 2- + I 2 0 ↔ S 4 O 6 2- + 2I -
Молекулярная форма:
2Na 2 S 2 O 3 + I 2 ↔ Na 2 S 4 O 6 + 2NaI
В данной реакции тиосульфат натрия выступает в роли восстановителя, увеличивая степень окисления одного атома серы от 0 до +4. При нагревании свыше 200 0С тиосульфат натрия распадается по схеме:
4Na 2 S 2 O 3Na 2 SO 4 + Na 2 S + 4S↓
При этом протекает реакция самоокисления-восстановления.
Реакции серной кислоты
Задача 867.
Составить уравнения реакций: а) концентрированной Н 2 SO 4 с магнием и с серебром; б) разбавленной Н 2 SO 4 с железом.
Решение:
а) 4Mg + 5Н
2 SO
4 (конц.) → 4MgSO 4 + H 2 S) + 4H 2 O;
б) 2Ag + 2Н
2 SO
(конц.) → Ag 2 SO 4 + SO 2 + 2H 2 O;
в) Fe + Н
2 SO
4 (разб.) → FeSO 4 + H 2 .
Задача 868.
Сколько граммов серной кислоты необходимо для растворения 50 г ртути? Сколько из них пойдет на окисление ртути? Можно ли для растворения ртути взять разбавленную серную кислоту?
Решение:
Уравнение реакции:
![]()
Уравнения ионно-молекулярного баланса:
Ионно-молекулярное уравнение:
Hg + SO 4 2- + 4H + ↔ Hg 2+ + SO 2 + 2H 2 O
Из уравнений окисления-восстановления следует, что на окисление 1 моль Hg затрачивается 1 моль H2SO4, следовательно,
200,5: 98 = 50: х ; х = (98 . 50)/200,5 = 24,44 г.
Находим массу H2SO4 из пропорции:
200,5: (2 . 98) = 50: х ; х = (2 . 98 . 50)/200,5 = 48,88 г.
Ответ: 48,88 г; 24,44 г. Ртуть стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на ртуть. Следовательно, для растворения ртути нужно взять концентрированную серную кислоту.
Задача 869.
Одинаковое ли количество серной кислоты потребуется для растворения 40 г никеля, если в одном случае взять концентрированную кислоту, а в другом разбавленную? Какая масса серной кислоты пойдет на окисление никеля в каждом случае?
Решение:
Уравнения реакций:
а) Ni + 2H 2 SO 4 (конц.) → NiSO4 + SO2 + 2H2O;
б) Ni + H 2 SO 4 (разб.) → NiSO4 + Н2.

Рассчитаем массу концентрированной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7: (2 . 98) = 40: х ; х = (2 . 98 . 40)/58,7 = 133,56, г.
Теперь рассчитаем массу разбавленной серной кислоты идущую на окисление 40 г никеля из пропорции:
58,7: 98 = 40: х ; х = (98 . 40)/58,7 = 66,78 г.
Ответ : 133,56 г; 66,78 г. На окисление никеля расходуется одинаковое количество серной кислоты.